ALLUZIENCE 200 unités Speywood/mL, solution injectable
Classe médicamenteuse
autres myorelaxants à action périphérique | code ATC : M03AX01
Composition
Complexe toxine A de Clostridium botulinum - hémagglutinine : 200 unités Speywood par mL.
Les unités de la toxine botulinique ne sont pas interchangeables d’un produit à l’autre. Les doses recommandées en unités Speywood sont différentes des autres préparations de toxine botulinique.
Chaque flacon contient 125 unités Speywood dans 0,625 mL de solution.
Indications thérapeutiques
Alluzience est indiqué dans la correction temporaire :
- des rides glabellaires modérées à sévères (rides verticales intersourcilières) observées lors du froncement maximum des sourcils, chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient.
Posologie et mode d'administration
Posologie
Les unités des produits à base de toxine botulinique sont différentes en fonction des médicaments. Les unités de la toxine botulinique ne sont pas interchangeables d’un produit à l’autre. Les doses recommandées en unités Speywood sont différentes de celles des autres préparations de toxine botulinique.
Population pédiatrique
La sécurité et l’efficacité d’Alluzience chez les enfants âgés de moins de 18 ans n’ont pas été établies. L’utilisation d’Alluzience n’est pas recommandée chez les patients âgés de moins de 18 ans.
Mode d’administration
Alluzience doit être administré uniquement par un médecin ayant les compétences adéquates et l’expérience de l’utilisation de ce traitement, et disposant du matériel approprié.
Un flacon d’Alluzience doit être utilisé uniquement pour le traitement d’un seul patient, au cours d’une seule séance d’injection.
Avant l’administration, la peau doit être nettoyée de tout maquillage et désinfectée avec un antiseptique local.
Les injections intramusculaires doivent être effectuées à l’aide d’une aiguille stérile de diamètre adapté.
Les doses et les intervalles de temps entre chaque traitement dépendent de l’évaluation de la réponse individuelle du patient.
Le délai médian d'apparition d’un effet rapporté subjectivement par les patients était de 3 jours (la majorité des patients ont signalé un effet dans les 2 à 3 jours, certains patients rapportant un effet dans les 24 heures). Un effet a été démontré jusqu'à 6 mois après l'injection.
L’intervalle entre deux traitements par Alluzience ne doit pas être inférieur à 3 mois.
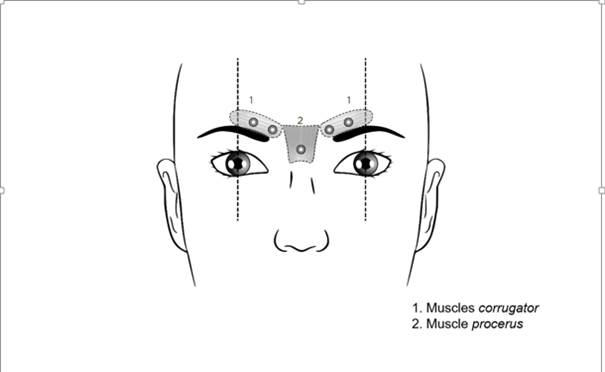
Les points d’injection recommandés pour les rides glabellaires sont décrits ci-après :
|
|
Instructions pour l’administration :
La dose totale recommandée est de 0,25 mL de solution (50 unités Speywood) à diviser en 5 sites d’injection, c’est-à-dire 0,05 mL de solution (10 unités Speywood) à administrer par injection intramusculaire dans chacun des 5 sites suivants : 2 injections dans chacun des muscles corrugator et une injection dans le muscle procerus près de l’angle nasofrontal.
Les repères anatomiques peuvent être plus facilement identifiés si leur palpation et leur observation sont effectuées lors du froncement maximum des sourcils par le patient. Avant injection, il faut placer fermement le pouce ou l’index sous le rebord orbitaire afin d’éviter l’extravasation sous le rebord orbitaire. L’aiguille doit être orientée vers le haut et vers la ligne médiane lors de l’injection. Pour diminuer le risque de ptosis, il faut éviter les injections à proximité du muscle releveur de la paupière supérieure, en particulier chez les patients dotés de puissants complexes abaisseurs des sourcils (depressor supercilii). Les injections dans le muscle corrugator doivent être effectuées dans la partie centrale du muscle, à au moins 1 cm au-dessus du rebord orbitaire.
Informations générales
En cas d’échec thérapeutique ou de diminution de l’effet après des injections répétées, il convient d’envisager d’autres méthodes thérapeutiques. En cas d’échec du traitement après la première séance, il y a lieu :
- d’analyser les causes de l’échec comme par exemple : muscles injectés incorrects, technique d’injection inappropriée, et formation d’anticorps neutralisant la toxine ;
- de réévaluer la pertinence du traitement par la toxine botulinique de type A.
Voie d'administration
intramusculaire
Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
- En cas d’infection au niveau des sites d’injection proposés.
- En cas de myasthénie grave, de syndrome de Lambert-Eaton ou de sclérose latérale amyotrophique.
Mise en garde et précautions d'emploi
Il faut veiller à ne pas injecter Alluzience dans un vaisseau sanguin.
L'injection d'Alluzience n'est pas recommandée chez les patients ayant des antécédents de dysphagie ou de fausse route.
Des effets indésirables, pouvant être liés à la diffusion de la toxine à distance du site d'injection, ont été très rarement rapportés avec la toxine botulinique. Les difficultés à avaler ou respirer sont des conséquences graves qui peuvent provoquer le décès.
De très rares cas de décès, parfois dans un contexte de dysphagie, de pneumopathie (incluant par exemple : dyspnée, insuffisance respiratoire, arrêt respiratoire) et/ou chez des patients souffrant d'une asthénie importante ont été rapportés après traitement par la toxine botulinique A ou B.
Les patients doivent être informés de la nécessité de consulter immédiatement un médecin en cas d'apparition de troubles de la déglutition, de l'élocution ou de troubles respiratoires.
Alluzience doit être utilisé avec prudence chez les patients présentant un risque ou des signes cliniques de déficit marqué de la transmission neuromusculaire. Ces patients peuvent avoir une sensibilité accrue aux substances comme la toxine botulinique, et une faiblesse musculaire excessive peut apparaître après le traitement.
Avant toute injection d'Alluzience, il est essentiel d'étudier l'anatomie faciale du patient. Une asymétrie faciale, un ptosis, une dermatochalasie excessive, des cicatrices et des modifications anatomiques résultant d'interventions chirurgicales antérieures doivent être prises en considération.
Des cas de sécheresse oculaire ont été rapportés lors de l'utilisation d'Alluzience dans les régions périoculaires (voir rubrique 4.8). Il est important de porter une attention particulière à cet effet indésirable car la sécheresse oculaire peut prédisposer à des troubles cornéens. Des gouttes protectrices, une pommade, l’occlusion de l'œil par un pansement ou d'autres moyens peuvent être nécessaires pour prévenir les troubles cornéens.
Il ne faut jamais dépasser la dose et la fréquence d'administration recommandées pour Alluzience.
Les patients traités avec la dose recommandée peuvent présenter une faiblesse musculaire exagérée.
La prudence s'impose lorsqu'Alluzience est utilisé en présence d'une inflammation aux sites d'injection proposés ou lorsque le(s) muscle(s) ciblé(s) présente(nt) une atrophie ou une faiblesse excessive. Des cas d’atrophie musculaire ont été rapportés après l’utilisation de la toxine botulinique (voir rubrique 4.8).
Comme pour toute injection intramusculaire, le traitement par Alluzience est déconseillé chez les patients présentant un temps de saignement allongé.
Chaque flacon d'Alluzience doit être utilisé pour le traitement d'un seul patient au cours d'une seule séance.
L'excédent de produit non utilisé doit être éliminé conformément aux instructions de la rubrique 6.6. Des précautions particulières doivent être prises pour l'inactivation et l'élimination de la solution reconstituée non utilisée (voire rubrique 6.6).
Formation d’anticorps
Les injections à intervalles trop rapprochés ou à doses trop élevées peuvent augmenter le risque de formation d'anticorps neutralisant la toxine botulinique. Au plan clinique, la formation d'anticorps neutralisants est susceptible de diminuer l'efficacité des traitements ultérieurs.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon de 125 U, c.-à-d. qu’il est essentiellement « sans sodium ».
Condition de prescription
prescription réservée aux spécialistes et services OPHTALMOLOGIE
Groupe générique
Non renseigné
Forme pharmaceutique
Non renseigné
Divers
Service Médical Rendu (SMR) : Non disponible
Présentation : 2 flacon(s) en verre de 0,625 ml
Prix : non disponible
Taux de remboursement : 0%
Titulaire : IPSEN PHARMA