TRIAFEMI, comprimé
Classe médicamenteuse
progestatifs et estrogènes pour administration séquentielle | code ATC : G03AB09
Composition
Norgestimate ................................................................................................................... 0,180 mg
Ethinylestradiol ................................................................................................................ 0,035 mg
Pour un comprimé blanc.
Norgestimate ................................................................................................................... 0,215 mg
Pour un comprimé bleu ciel.
Norgestimate ................................................................................................................... 0,250 mg
Pour un comprimé bleu foncé.
Excipient à effet notoire : lactose anhydre
Indications thérapeutiques
Contraception orale chez la femme ayant une acné légère à modérée; ce traitement contraceptif ne dispense pas d'un traitement spécifique de l'acné si celui-ci est nécessaire.
La décision de prescrire TRIAFEMI doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à TRIAFEMI en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
Posologie et mode d'administration
Voie d’administration : voie orale.
Posologie
Comment prendre TRIAFEMI
Prendre régulièrement et sans oubli 1 comprimé par jour au même moment de la journée (celui où vous risquez le moins d’oublier), pendant 21 jours consécutifs avec un arrêt de 7 jours entre deux plaquettes.
Le 1er jour d’utilisation de votre plaquette, collez l’étiquette* du jour de la semaine correspondant et prenez le comprimé numéro 1. Les jours suivants prenez les comprimés environ à la même heure de la journée, dans l’ordre chronologique jusqu’au 21ème jour.
Ensuite, vous ne prendrez plus de comprimés pendant 7 jours. Une hémorragie de privation doit apparaître pendant cet intervalle, généralement le 2ème ou le 3ème jour après la prise du dernier comprimé.
Commencez la plaquette suivante dès le 8ème jour, même si l’hémorragie de privation persiste. Vous devez toujours commencer la plaquette suivante le même jour de la semaine.
*Les étiquettes sont disponibles dans votre boite.
Mode d’administration
Comment débuter TRIAFEMI
- Début du traitement de l'acné et de la contraception orale (Pas de prise antérieure d’une contraception hormonale (au cours du mois précédent) :
La prise des comprimés doit commencer le jour 1 du cycle naturel de la femme (c'est-à-dire le premier jour de ses règles).
On peut commencer entre les jours 2-5, mais dans ce cas une méthode barrière supplémentaire est recommandée pendant les 7 premiers jours du premier cycle.
- En relais d’une contraception hormonale combinée (contraceptif oral combiné (COC), anneau vaginal ou dispositif transdermique) :
La femme doit commencer TRIAFEMI de préférence le jour après le dernier comprimé actif (le dernier comprimé contenant les substances actives) de son COC précédent, mais au plus tard le jour suivant l’intervalle sans comprimés habituel ou l’intervalle des comprimés placebo de son COC précédent.
Dans le cas où un anneau vaginal ou un dispositif transdermique a été utilisé, la femme devra commencer à prendre TRIAFEMI de préférence le jour du retrait, mais au plus tard le jour où la pose suivante est prévue.
- En relais d’une contraception par un progestatif seul (contraceptif oral, forme injectable ou implant contenant un progestatif seul) ou d’un système intra-utérin (SIU) contenant un progestatif :
La femme peut changer n’importe quel jour de la pilule progestative seule (d'un implant ou d’un SIU le jour de son retrait, d'un produit injectable quand l'injection suivante est prévue), mais doit dans tous ces cas être conseillée d’utiliser une méthode barrière supplémentaire pendant les 7 premiers jours de prise de comprimés.
- Après un avortement au cours du premier trimestre :
La femme peut commencer immédiatement. Ce faisant, elle n’a pas besoin de prendre de mesures contraceptives supplémentaires.
- Après un accouchement ou un avortement au cours du deuxième trimestre :
Les femmes doivent être informées de commencer au jour 21 à 28 après l'accouchement ou l'avortement du deuxième trimestre. En commençant plus tard, la femme devra être informée d'utiliser une méthode barrière supplémentaire pendant les 7 premiers jours. Cependant, si des rapports sexuels ont déjà eu lieu, une grossesse devra être exclue avant de commencer le COC ou la femme doit attendre ses premières règles.
En cas d'allaitement, voir rubrique 4.6.
Conduite en cas d'oubli de comprimés
Si l’utilisatrice à moins de 12 heures de retard dans la prise d’un comprimé, la protection contraceptive n’est pas réduite. La femme doit prendre le comprimé dès qu'elle s’en souvient et prendre les comprimés suivants à l’heure habituelle.
Si elle a plus de 12 heures de retard dans la prise d’un comprimé, la protection contraceptive peut être réduite.
La conduite à tenir pour les comprimés oubliés peut être guidée par les deux règles de base suivantes :
1. La prise des comprimés ne doit jamais être interrompue pendant plus de 7 jours.
2. 7 jours de prise ininterrompue de comprimés sont requis pour atteindre une inhibition adéquate de l'axe hypothalamo-hypophyso-ovarien.
En conséquence, les conseils suivants peuvent être donnés dans la pratique quotidienne :
- Semaine 1 (Jour 1 à 7)
La femme doit prendre le dernier comprimé oublié dès qu'elle s’en souvient, même si cela signifie de prendre deux comprimés en même temps. Elle continue ensuite à prendre les comprimés à son heure habituelle. En plus, une méthode barrière comme un préservatif doit être utilisée pendant les 7 jours suivants. Si des rapports sexuels ont eu lieu pendant les 7 jours précédents, la possibilité d’une grossesse doit être considérée. Plus il y a de comprimés oubliés et plus ils sont proches de la phase de l’intervalle sans comprimés, plus le risque de grossesse est élevé.
- Semaine 2 (Jour 8 à 14)
La femme doit prendre le dernier comprimé oublié dès qu'elle s’en souvient, même si cela signifie de prendre deux comprimés en même temps. Elle continue ensuite à prendre les comprimés à son heure habituelle. Pour autant que la femme a pris ses comprimés correctement au cours des 7 jours précédant le premier comprimé oublié, il n'est pas nécessaire d’utiliser de précautions contraceptives supplémentaires. Toutefois, si elle a oublié plus d’un comprimé, il sera conseillé à la femme d’utiliser des précautions supplémentaires pendant 7 jours.
- Semaine 3 (Jour 15 à 21)
Le risque de diminution de la fiabilité est imminent en raison de la proximité des 7 jours d’intervalle sans comprimés. Toutefois, en ajustant le schéma de prise des comprimés, une diminution de la protection contraceptive peut encore être prévenue. En suivant l’une des deux options suivantes, il n’est ainsi pas nécessaire de prendre des précautions contraceptives supplémentaires, à condition que pendant les 7 jours précédant le premier comprimé oublié la femme a pris tous les comprimés correctement. Si ce n’est pas le cas, elle doit suivre la première de ces deux options et prendre aussi des précautions supplémentaires pendant les 7 jours suivants.
1. La femme doit prendre le dernier comprimé oublié dès qu'elle s’en souvient, même si cela signifie de prendre deux comprimés en même temps. Elle continue ensuite à prendre les comprimés à son heure habituelle. La plaquette suivante doit être commencée dès que la plaquette en cours est terminée, c’est-à-dire aucun intervalle ne doit être laissé entre les plaquettes. Il est peu probable que la femme ait une hémorragie de privation jusqu’à la fin des comprimés actifs de la seconde plaquette, mais elle peut présenter des spottings ou hémorragies de rupture pendant les jours de prise des comprimés.
2. La femme devra être informée d'arrêter la prise des comprimés de la plaquette en cours. Elle devra alors avoir un intervalle sans comprimés de 7 jours, incluant les jours où elle a oublié les comprimés, et ensuite continuer avec la plaquette suivante.
Si la femme a oublié des comprimés et n’a donc pas d’hémorragie de privation lors du premier intervalle sans comprimés, la possibilité d’une grossesse doit être considérée.
Comment changer le jour de début des règles ou reporter une hémorragie de privation
Pour retarder une hémorragie de privation, la femme doit continuer avec une autre plaquette de TRIAFEMI sans intervalle sans comprimés. La prolongation peut être poursuivie aussi longtemps que souhaité jusqu’à la fin de la seconde plaquette. Durant cette prolongation la femme peut avoir une hémorragie de rupture ou des spottings. La prise habituelle de TRIAFEMI est ensuite réinstaurée après l’habituel intervalle sans comprimés de 7 jours.
Si la femme veut changer le jour de début de son hémorragie de privation à un autre jour de la semaine, on peut lui conseiller de réduire le prochain intervalle sans comprimés d’autant de jours qu'elle le souhaite. Plus l'intervalle est court, plus le risque est élevé qu’elle n’ait pas d'hémorragie de privation mais une hémorragie de rupture ou des spottings pendant la plaquette suivante (tout comme pour retarder l’hémorragie de privation).
Conseils en cas de troubles gastro-intestinaux
En cas de vomissements ou diarrhée sévère, l’absorption des substances actives peut ne pas être complète et des mesures contraceptives supplémentaires sont à prendre.
Si des vomissements ou diarrhée sévère surviennent dans les 3-4 heures après la prise d’un comprimé actif, un nouveau (remplacement) comprimé doit être pris dès que possible. Le nouveau comprimé doit être pris dans les 12 heures suivant le moment de prise habituelle si possible. Si plus de 12 heures se sont écoulées, le conseil concernant l’oubli de comprimés comme donné en rubrique 4.2 « Conduite en cas d'oubli de comprimés » est applicable. Si la femme ne souhaite pas modifier son calendrier habituel de prise de comprimés, elle doit prendre le(s) comprimé(s) supplémentaire(s) d’une autre plaquette.
Personnes âgées
L’utilisation de ce produit n’est pas indiquée chez les femmes post-ménopausées.
Population pédiatrique
TRIAFEMI est contre-indiqué chez les filles qui n’ont pas atteint l’âge de la puberté – avant la ménarche.
Voie d'administration
orale
Contre-indications
Les contraceptifs hormonaux combinés (CHC) ne doivent pas être utilisés dans les situations suivantes.
En cas de survenue pour la première fois de l'une de ces pathologies lors de la prise d'une contraception orale, interrompre immédiatement le traitement.
- Présence ou risque de thrombo-embolie veineuse (TEV) :
• Thrombo-embolie veineuse – présence de TEV (patient traité par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP]);
• Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S ;
• Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4) ;
• Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4).
- Présence ou risque de thrombo-embolie artérielle (TEA) :
• Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine) ;
• Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT]) ;
• Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique) ;
• Antécédents de migraine avec signes neurologiques focaux ;
• Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
§ diabète avec symptômes vasculaires,
§ hypertension artérielle sévère,
§ dyslipoprotéinémie sévère.
- Présence ou antécédents d’affection hépatique sévère tant que les valeurs de la fonction hépatique ne sont pas revenues à la normale.
- Présence ou antécédents de tumeurs hépatiques (bénignes ou malignes).
- Présence ou suspicion d’affections malignes dépendant de stéroïdes sexuels (par exemple des organes génitaux ou des seins).
- Hyperplasie endométriale.
- Hémorragie vaginale non diagnostiquée.
- Jaunisse cholestatique de la grossesse ou jaunisse liée à une utilisation antérieure de la pilule.
- Grossesse connue ou suspectée.
- Cardiopathie valvulaire avec complications.
- Présence ou antécédents de pancréatite associée à une sévère hypertriglycéridémie.
- Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
TRIAFEMI est contre-indiqué lors de l’utilisation concomitante de médicaments contenant de l’ombitasvir/paritaprévir/ritonavir et dasabuvir ou de médicaments contenant du glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir (voir 4.5).
Mise en garde et précautions d'emploi
Mises en garde
Si la patiente présente l’un des troubles ou l’un des facteurs de risque mentionnés ci-dessous, la pertinence du traitement par TRIAFEMI doit être discutée avec elle.
En cas d’aggravation ou de survenue de l’un de ces troubles ou facteurs de risque, la nécessité d’interrompre l’utilisation de TRIAFEMI doit être discutée entre le médecin et la patiente.
Consultation/examen médical
Avant l’instauration ou la reprise d’un traitement par TRIAFEMI, une recherche complète des antécédents médicaux (y compris les antécédents familiaux) doit être effectuée et la présence d’une grossesse doit être exclue. La pression artérielle doit être mesurée et un examen physique doit être réalisé, en ayant à l’esprit les contre-indications (voir rubrique 4.3) et les mises en garde (voir rubrique 4.4).
Il est important d’attirer l’attention des patientes sur les informations relatives à la thrombose veineuse et artérielle, y compris le risque associé à TRIAFEMI comparé à celui associé aux autres CHC, les symptômes de la TEV et de la TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
Il doit également être indiqué aux patientes de lire attentivement la notice et de suivre les conseils fournis.
La fréquence et la nature des examens doivent être définies sur la base des recommandations en vigueur et adaptées à chaque patiente.
Les patientes doivent être averties que les contraceptifs hormonaux ne protègent pas contre l’infection par le VIH (SIDA) et les autres maladies sexuellement transmissibles.
- Troubles circulatoires
Risque de thrombo-embolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes qui utilisent un contraceptif hormonal combiné (CHC) en comparaison aux femmes qui n’en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate (incluant TRIAFEMI) ou de la noréthistérone sont associés au risque de TEV le plus faible. La décision d’utiliser TRIAFEMI doit être prise uniquement après concertation avec la patiente afin de s’assurer qu’elle comprend le risque de TEV associé à TRIAFEMI l’influence de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal pendant la première année d’utilisation. Certaines données indiquent également une augmentation du risque lors de la reprise d’un CHC après une interruption de 4 semaines ou plus.
Parmi les femmes qui n’utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d’un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu’elle présente (voir ci-dessous).
On estime que sur 10 000 femmes qui utilisent un CHC contenant du lévonorgestrel, environ 61 développeront une TEV sur une période d’un an.
Les données disponibles à ce jour suggèrent que le risque de TEV associé à l’utilisation de CHC contenant du norgestimate est similaire à celui associé à l’utilisation de CHC contenant du lévonorgestrel.
Ce nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2 % des cas.
1. Point central de l’intervalle de 5‑7 pour 10 000 années-femmes sur la base d’un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d’un CHC, d’environ 2,3 à 3,6
Nombre de cas de TEV pour 10 000 femmes sur une période d’un an

De façon extrêmement rare, des cas de thrombose ont été signalés chez des utilisatrices de CHC dans d’autres vaisseaux sanguins, p. ex. les veines et artères hépatiques, mésentériques, rénales ou rétiniennes.
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d’autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous).
TRIAFEMI est contre-indiqué chez les femmes présentant de multiples facteurs de risque, ceux-ci les exposant à un risque élevé de thrombose veineuse (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global de TEV doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEV
|
Facteur de risque |
Commentaire |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m²). |
L’élévation de l’IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte si d’autres facteurs de risque sont présents. |
|
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur. Remarque : l’immobilisation temporaire, y compris les trajets aériens > 4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d’autres facteurs de risque. |
Dans ces situations, il est conseillé de suspendre l’utilisation de la pilule (au moins quatre semaines à l’avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d’éviter une grossesse non désirée. Un traitement anti-thrombotique devra être envisagé si TRIAFEMI n’a pas été interrompu à l’avance. |
|
Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans). |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Autres affections médicales associées à la TEV. |
Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique) et drépanocytose. |
|
Âge. |
En particulier au-delà de 35 ans. |
Il n’existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l’apparition ou la progression d’une thrombose veineuse.
L’augmentation du risque de thrombo-embolie pendant la grossesse, et en particulier pendant les 6 semaines de la période puerpérale, doit être prise en compte (pour des informations concernant « Grossesse et allaitement », voir rubrique 4.6).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC. Les symptômes de la thrombose veineuse profonde (TVP) peuvent inclure :
- Gonflement unilatéral d’une jambe et/ou d’un pied ou le long d’une veine de la jambe.
- Douleur ou sensibilité dans une jambe, pouvant n’être ressentie qu’en position debout ou lors de la marche.
- Sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
Les symptômes de l’embolie pulmonaire (EP) peuvent inclure :
- Apparition soudaine et inexpliquée d’un essoufflement ou d’une accélération de la respiration.
- Toux soudaine, pouvant être associée à une hémoptysie.
- Douleur thoracique aiguë.
- Étourdissements ou sensations vertigineuses sévères.
- Battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (p. ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d’événements plus fréquents ou moins sévères (infections respiratoires, p. ex.).
Les autres signes d’une occlusion vasculaire peuvent inclure : douleur soudaine, gonflement et coloration légèrement bleutée d’une extrémité.
Si l’occlusion se produit dans l’œil, les symptômes peuvent débuter sous la forme d’une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l’utilisation de CHC et l’augmentation du risque de thrombo-embolie artérielle (infarctus du myocarde) ou d’accident cérébrovasculaire (p. ex. accident ischémique transitoire, AVC). Les événements thrombo-emboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d’accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir le tableau).TRIAFEMI est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle (voir rubrique 4.3).
Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEA
|
Facteur de risque |
Commentaire |
|
Âge |
En particulier au-delà de 35 ans |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d’utiliser une méthode de contraception différente. |
|
Hypertension artérielle |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
L’élévation de l’IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte chez les femmes présentant d’autres facteurs de risque. |
|
Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Migraine |
L’accroissement de la fréquence ou de la sévérité des migraines lors de l’utilisation d’un CHC (qui peut être le prodrome d’un événement cérébrovasculaire) peut constituer un motif d’arrêt immédiat du CHC. |
|
Autres affections médicales associées à des événements indésirables vasculaires |
Diabète, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé |
Symptômes de TEA
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes d’un accident cérébrovasculaire peuvent inclure :
- Apparition soudaine d’un engourdissement ou d’une faiblesse du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps.
- Apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination.
- Apparition soudaine d’une confusion, de difficultés à parler ou à comprendre.
- Apparition soudaine de difficultés à voir d’un œil ou des deux yeux.
- Céphalée soudaine, sévère ou prolongée, sans cause connue.
- Perte de conscience ou évanouissement avec ou sans crise convulsive.
- Des symptômes temporaires suggèrent qu’il s’agit d’un accident ischémique transitoire (AIT).
Les symptômes de l’infarctus du myocarde (IM) peuvent inclure :
- Douleur, gêne, pression, lourdeur, sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum.
- Sensation de gêne irradiant vers le dos, la mâchoire, la gorge, le bras, l’estomac.
- Sensation d’encombrement, d’indigestion ou de suffocation.
- Transpiration, nausées, vomissements ou sensations vertigineuses.
- Faiblesse, anxiété ou essoufflement extrêmes.
- Battements cardiaques rapides ou irréguliers.
Adénomes hépatiques
Dans de rares cas, des tumeurs bénignes du foie, et dans de plus rares cas encore, des tumeurs malignes du foie ont été rapportées chez les utilisatrices de COC.
Dans des cas isolés, ces tumeurs ont conduit à des hémorragies intra-abdominales mettant en jeu le pronostic vital. Chez les femmes sous COC, la survenue de douleurs de la partie supérieure de l’abdomen, d’augmentation du volume du foie ou de signes d’hémorragie intra-abdominale doit faire évoquer une tumeur hépatique.
Cancer du sein
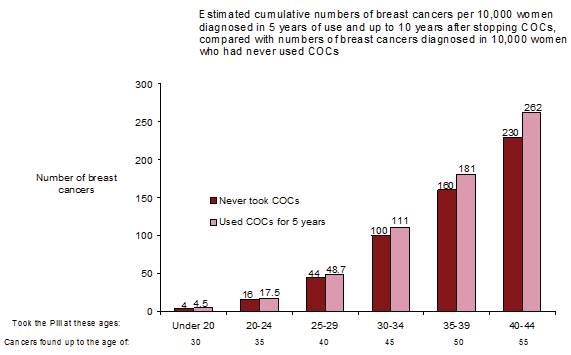
Une méta-analyse de 54 études épidémiologiques a conclu qu’il existe une légère augmentation du risque relatif (RR = 1,24) de cancer du sein chez les femmes sous contraception orale. Cette majoration du risque disparaît progressivement au cours des 10 années qui suivent l’arrêt du COC.
Le cancer du sein étant rare chez les femmes de moins de 40 ans, le nombre plus élevé de cancers diagnostiqués chez les utilisatrices habituelles ou nouvelles utilisatrices de COC reste faible par rapport au risque global de cancer du sein.
Le cancer du sein est rare chez les femmes de moins de 40 ans, qu'elles prennent ou non des COC. Bien que ce risque de fond augmente avec l'âge, le nombre excessif de diagnostics de cancer du sein chez les utilisatrices actuelles et récentes de COC est faible par rapport au risque global de cancer du sein (voir le diagramme à barres).
Le facteur de risque le plus important du cancer du sein chez les utilisatrices de COC est l'âge auquel les femmes arrêtent le COC; plus l'âge d'arrêt est élevé, plus le nombre de cancers du sein diagnostiqués est élevé. La durée d'utilisation est moins importante et l'excès de risque disparaît progressivement au cours des 10 années suivant l'arrêt de l'utilisation des COC, de sorte qu'à 10 ans, il ne semble plus y avoir d'excès.
L’augmentation possible du risque de cancer du sein doit être discutée avec l’utilisatrice et comparée aux avantages des COC, en tenant compte des preuves qu’ils offrent une protection substantielle contre le risque de développer certains autres cancers (par exemple les cancers de l’ovaire et de l’endomètre).
|
|
Cancer du col de l’utérus
Certaines études épidémiologiques suggèrent que les COC pourraient être associés à une augmentation du risque de cancer du col de l’utérus chez les utilisatrices de COC à long terme (> 5 ans). Il n’est cependant pas établi si ces pathologies sont dues à d’autres facteurs comme le comportement sexuel et le papillomavirus humain (HPV).
Autres tumeurs
L’utilisation de COC plus fortement dosés (50 µg éthinylestradiol) diminue le risque de cancer de l’endomètre et de l’ovaire. Ceci demande à être confirmé avec les COC plus faiblement dosés.
Troubles du cycle
Des saignements irréguliers (« spottings » ou métrorragies) peuvent survenir sous COC en particulier au cours des premiers mois. Ces saignements irréguliers seront considérés comme significatifs s’ils persistent après environ 3 cycles.
Si les saignements irréguliers persistent ou surviennent après des cycles réguliers, une recherche étiologique non hormonale doit alors être effectuée ; des examens diagnostiques appropriés doivent être pratiqués afin d’exclure une tumeur maligne ou une grossesse. Ces examens peuvent comporter un curetage.
Chez certaines femmes, les hémorragies de privation peuvent ne pas survenir au cours de l’intervalle libre. Si le COC a été pris tel que décrit dans la rubrique 4.2, il est peu probable que la femme soit enceinte. Cependant, si le COC n’a pas été pris correctement avant l’absence de la première hémorragie de privation ou si deux hémorragies de privation successives ne se produisent pas, il convient de s’assurer de l’absence de grossesse avant de poursuivre le COC.
Autres affections
Chez les femmes atteintes d’hypertriglycéridémie ou ayant des antécédents familiaux d’hypertriglycéridémie, un risque accru de pancréatite peut survenir en cas d’utilisation d’un COC.
Une augmentation modérée de la pression artérielle a été observée chez de nombreuses femmes sous COC mais elle était rarement cliniquement significative. Une interruption immédiate du COC n’est justifiée que dans ces rares cas. La persistance de chiffres tensionnels élevés ou le non contrôle des chiffres tensionnels par un traitement antihypertenseur chez une femme hypertendue prenant un COC doit faire interrompre celui-ci. Le COC pourra éventuellement être repris après normalisation des chiffres tensionnels par un traitement antihypertenseur.
La survenue ou l’aggravation des pathologies suivantes a été observée au cours de la grossesse ou chez des femmes prenant des COC, bien que la responsabilité des COC n’ait pu être établie : ictère et/ou prurit dû à une cholestase, lithiase biliaire, porphyrie, lupus érythémateux disséminé, syndrome hémolytico-urémique, chorée de Sydenham, herpès gravidique, hypoacousie par otosclérose.
Les œstrogènes exogènes peuvent déclencher ou aggraver les symptômes d’un angio-oedème héréditaire ou acquis.
La survenue d’anomalie hépatiques aiguës ou chroniques peut nécessiter l’arrêt du COC jusqu’à la normalisation des paramètres hépatiques. La récidive d’un ictère cholestatique et/ou d’un prurit liée à une cholestase survenue au cours d’une grossesse précédente ou de la prise antérieure d’hormones stéroïdiennes doit faire arrêter le COC.
Les COC peuvent avoir un effet sur la résistance périphérique à l’insuline et la tolérance au glucose ; il n’est cependant pas obligatoire de modifier le traitement chez des diabétiques utilisant un CHC faiblement dosé (contenant moins de 0,05 mg d’éthinylestradiol). Les femmes diabétiques doivent cependant être étroitement surveillées, en particulier lors de l’instauration d’un COC.
Des cas d’aggravation de dépression endogène, d’épilepsie, de maladie de Crohn et de rectocolite hémorragique ont été observés sous COC.
Un chloasma peut survenir, en particulier chez les femmes ayant des antécédents de chloasma gravidique. Les femmes ayant une prédisposition au chloasma sous COC doivent éviter de s’exposer au soleil ou aux rayons ultra-violets.
L’état dépressif et la dépression sont des effets indésirables bien connus liés à l’utilisation de contraceptifs hormonaux (voir rubrique 4.8). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur médecin en cas de changements d’humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Excipients
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Condition de prescription
liste I
Groupe générique
ETHINYLESTRADIOL 0,035 mg + NORGESTIMATE 0,180 mg - TRIAFEMI, comprimé
Liste des médicaments de ce groupe de générique.Forme pharmaceutique
Non renseigné
Divers
Service Médical Rendu (SMR) : Non disponible
Présentation : 3 plaquette(s) thermoformée(s) PVC PVDC Aluminium de 21 comprimés (7 comprimés blancs, 7 comprimés bleu ciel et 7 comprimés bleu foncé)
Prix : non disponible
Taux de remboursement : 0%
Titulaire : EFFIK