FLUANXOL 4 %, solution buvable
Classe médicamenteuse
antipsychotique - dérivé Thioxanthène | code ATC : N05AF01
Composition
Dichlorhydrate de flupentixol.................................................................................................. 4,67 g
Quantité correspondant en flupentixol base à.......................................................................... 4,00 g
Pour 100 ml.
Excipient à effet notoire : Contient 300 mg d'éthanol par ml.
Indications thérapeutiques
Etats psychotiques aigus.
Etats psychotiques chroniques (schizophrénies, délires chroniques non schizophréniques : délires paranoïaques, psychoses hallucinatoires chroniques).
Traitement de courte durée des états d'agitation et d'agressivité au cours des états psychotiques aigus et chroniques (schizophrénies, délires chroniques non schizophréniques : délires paranoïaques, psychoses hallucinatoires chroniques).
Posologie et mode d'administration
Posologie
Chez l'adulte
Posologie strictement individuelle en fonction du tableau clinique :
- effet antipsychotique associé à un effet stimulant et désinhibiteur sans effet anxiogène : de 20 à 80 mg/jour en 1 à 2 prises,
- effet antidélirant et anti-hallucinatoire associé à un effet sédatif : de 80 à 200 mg/jour éventuellement jusqu'à 400 mg/jour en milieu hospitalier.
Mise en route du traitement : dose de départ en moyenne de 20 à 40 mg/jour, puis augmentation par paliers de 20 à 40 mg tous les 3 à 4 jours, enfin modulations de ± 10 mg pour rechercher la posologie la plus adéquate.
Chez les sujets âgés, les patients épileptiques
Posologie réduite à la moitié ou au quart de la posologie mentionnée ci-dessus.
Population pédiatrique
Sans objet.
Mode d’administration
Voie orale.
1. Appuyer sur le bouchon et dévisser.
2. Placer la seringue doseuse pour administration orale dans l’orifice du système d’adaptation.
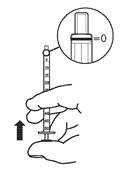
3. Renverser le flacon et la seringue doseuse pour administration orale puis aspirer la solution buvable. Le volume aspiré dans la seringue doseuse pour administration orale doit être légèrement supérieur à celui prescrit.
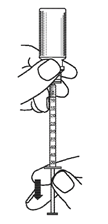
4. Appuyer sur le piston de la seringue doseuse pour administration orale afin d’éliminer le surplus de solution et d’obtenir la dose exacte prescrite.
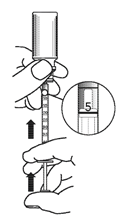
5. Retourner le flacon et la seringue doseuse pour administration orale avant de séparer la seringue à usage orale du flacon.
Refermer le flacon.
6. Verser le contenu de la seringue doseuse pour administration orale dans votre boisson (un verre d’eau, de jus d’orange ou de pomme), mélanger brièvement et boire la totalité.
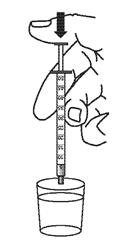
7. Laver la seringue doseuse pour administration orale à l’eau.
Voie d'administration
orale
Contre-indications
Ce médicament est contre-indiqué dans les situations suivantes :
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
- risque de glaucome par fermeture de l’angle,
- risque de rétention urinaire lié à des troubles urétro-prostatiques,
- troubles de la conscience quelle qu’en soit la cause (par exemple intoxication à l’alcool, aux barbituriques ou aux opiacés), coma,
- en association avec un dopaminergique hors parkinson (cabergoline, quinagolide), le citalopram, l’escitalopram, l’hydroxyzine, la dompéridone, la pipéraquine (voir rubrique 4.5).
Mise en garde et précautions d'emploi
En cas d’hyperthermie inexpliquée, il est impératif de suspendre le traitement, car ce signe peut être l’un des éléments du syndrome malin décrit avec les neuroleptiques (pâleur, hyperthermie, troubles végétatifs, altération de la conscience, rigidité musculaire).
Les signes de dysfonctionnement végétatif, tels que sudation et instabilité artérielle, peuvent précéder l’apparition de l’hyperthermie et constituer, par conséquent, des signes d’appel précoces.
Bien que cet effet des neuroleptiques puisse avoir une origine idiosyncrasique, certains facteurs de risque semblent y prédisposer, tels que la déshydratation ou des atteintes organiques cérébrales.
Les symptômes peuvent persister pendant plus d’une semaine après l’arrêt des neuroleptiques oraux et légèrement plus longtemps lorsqu’ils sont associés aux formes LP de ces médicaments.
Une surveillance chez les patients épileptiques et les sujets présentant d’autres facteurs prédisposants (atteinte cérébrale) peut être conseillée en raison de la possibilité d’abaissement du seuil épileptogène.
Le flupentixol n’est pas recommandé chez les patients excités ou délirants aux doses allant jusqu’à 25 mg/jour car son effet stimulant peut conduire à une exagération de ces caractéristiques. Si le patient a précédemment été traité avec des tranquillisants ou des neuroleptiques avec un effet sédatif, ils doivent être arrêtés progressivement.
Le flupentixol doit également être utilisé avec prudence :
- chez les sujets âgés en raison de leur importante sensibilité (sédation et hypotension),
- chez les patients ayant une affection cardio-vasculaire grave, en raison des modifications hémodynamiques, en particulier l’hypotension,
- chez les patients ayant une insuffisance rénale ou hépatique, en raison du risque de surdosage,
- chez les parkinsoniens nécessitant impérativement un traitement neuroleptique.
Allongement de l’intervalle QT
Le flupentixol peut provoquer un allongement de l’espace QT. Cet effet, connu pour potentialiser le risque de survenue de troubles du rythme ventriculaire graves, notamment à type de torsades de pointes, est majoré par l’existence d’une bradycardie, d’une hypokaliémie, d’un QT long congénital ou acquis (association à un médicament augmentant l’intervalle QT) (voir rubrique 4.8).
Il convient donc lorsque la situation clinique le permet, de s’assurer avant toute administration, de l’absence de facteurs pouvant favoriser la survenue de ce trouble du rythme :
- bradycardie inférieure à 55 battements par minute,
- hypokaliémie,
- allongement congénital de l’intervalle QT,
- traitement en cours par un médicament susceptible d’entraîner une bradycardie marquée (< 55 battements par minute), une hypokaliémie, un ralentissement de la conduction intracardiaque, un allongement de l’intervalle QT (voir rubrique 4.5).
Hormis les situations d’urgence, il est recommandé d’effectuer un ECG dans le bilan initial des patients devant être traités au long cours par un neuroleptique.
Des cas d’hyperglycémie ou d’intolérance au glucose et la survenue ou l’exacerbation d’un diabète ont été rapportés chez des patients traités par des antipsychotiques (voir rubrique 4.8).
Les patients traités par FLUANXOL doivent faire l’objet d’une surveillance clinique et biologique conforme aux recommandations sur le suivi cardio-métabolique en vigueur. Il est recommandé de porter une attention particulière aux patients diabétiques ou ayant des facteurs de risque de diabète et de réajuster éventuellement le traitement antidiabétique.
Des cas de thromboembolie veineuse (TEV) ont été rapportés avec les antipsychotiques. Etant donné que les patients traités par antipsychotiques présentent souvent des facteurs de risque acquis de TEV, tous les facteurs de risque de survenue de TEV doivent être identifiés avant et au cours du traitement par FLUANXOL et des mesures préventives doivent être prises le cas échéant.
Personnes âgées
Accident vasculaire cérébral
Dans des études cliniques randomisées versus placebo réalisées chez des patients âgés atteints de démence et traités avec certains antipsychotiques atypiques, il a été observé un risque plus élevé d’accident vasculaire cérébral comparé au placebo. Le mécanisme d’une telle augmentation de risque n’est pas connu. Une élévation du risque avec d’autres antipsychotiques ou chez d’autres populations de patients ne peut être exclue. Ce médicament doit être utilisé avec prudence chez les patients présentant des facteurs de risque d’accident vasculaire cérébral.
Augmentation de la mortalité chez les patients âgés atteints de démence
Les résultats de deux études observationnelles menées chez un grand nombre de patients ont montré que les patients âgés atteints de démence et traités par antipsychotiques présentent une faible augmentation du risque de mortalité comparés à ceux qui ne sont pas traités. Les données disponibles sont insuffisantes pour établir une estimation précise de ce risque et la cause de cette augmentation est inconnue.
FLUANXOL n’est pas indiqué dans le traitement des troubles du comportement liés à la démence.
Liées aux excipients
Ce médicament contient 300 mg d’alcool (éthanol 96%) dans chaque ml, ce qui équivaut à 35,6 % v/v. La quantité contenue dans 1 ml de ce médicament est équivalente à 8 ml de bière ou 3 ml de vin. La quantité d'alcool contenue dans ce médicament n'est pas susceptible d'avoir un effet chez les adultes.
L’utilisation de ce médicament est dangereuse chez les sujets alcooliques et doit être prise en compte chez les femmes enceintes ou allaitant, les enfants et les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques.
Condition de prescription
liste I
Groupe générique
Non renseigné
Forme pharmaceutique
Non renseigné
Divers
Service Médical Rendu (SMR) : Important
Présentation : 1 flacon(s) en verre jaune(brun) de 10 ml avec seringue(s) doseuse pour administration orale en polypropylène polyéthylène
Prix : 6.36
Taux de remboursement : 65%
Titulaire : LUNDBECK SAS