TRAVOPROST VIATRIS 40 microgrammes/mL, collyre en solution
Classe médicamenteuse
Ophtalmologiques-préparations antiglaucomateuses et myotiques-analogues des prostaglandines | code ATC : S01E
Composition
Chaque ml de solution contient 40 microgrammes de travoprost.
Excipient à effet notoire :
Chaque ml de solution contient 150 microgrammes de chlorure de benzalkonium (voir rubrique 4.4).
Indications thérapeutiques
Réduction de la pression intraoculaire élevée chez les patients adultes atteints d’hypertonie intraoculaire ou de glaucome à angle ouvert (voir rubrique 5.1).
Réduction de la pression intraoculaire élevée chez les patients pédiatriques âgés de 2 mois à < 18 ans atteints d’hypertonie intraoculaire ou de glaucome pédiatrique (voir rubrique 5.1).
Posologie et mode d'administration
Posologie
Utilisation chez les adultes et les sujets âgés
La posologie est d’une goutte de TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution dans le cul-de-sac conjonctival de l’œil ou des yeux atteint(s) une fois par jour. L’effet est optimal si le traitement est administré le soir.
Une occlusion nasolacrymale ou une fermeture douce des paupières après administration est recommandée. Ceci peut réduire l’absorption systémique des médicaments administrés par voie oculaire et conduire à une diminution des effets indésirables systémiques.
En cas d’utilisation de plusieurs collyres, les médicaments doivent être administrés avec au moins 5 minutes d’écart (voir rubrique 4.5).
Si une instillation est oubliée, le traitement doit être poursuivi avec l'instillation suivante comme prévu. La posologie ne doit pas dépasser une goutte par jour dans l’œil ou les yeux atteint(s).
En cas de remplacement d’un autre médicament antiglaucomateux ophtalmique par le travoprost en collyre, l’autre médicament doit être interrompu et le travoprost en collyre doit être commencé le jour suivant.
Insuffisants hépatiques et rénaux
Le travoprost a été étudié chez les insuffisants hépatiques modérés à sévères et chez les insuffisants rénaux modérés à sévères (clairance de la créatinine jusqu’à 14 ml/min). Aucune adaptation de la posologie n’est nécessaire chez ces patients (voir rubrique 5.2).
Population pédiatrique
Le travoprost peut être utilisé chez les patients pédiatriques âgés de 2 mois à < 18 ans à la même posologie que chez l’adulte. Cependant, les données pour le groupe d’âge 2 mois à < 3 ans (9 patients) sont limitées (voir rubrique 5.1).
La sécurité et l’efficacité du travoprost chez les enfants âgés de moins de 2 mois n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Voie oculaire
Les patients portant des lentilles de contact doivent se référer à la rubrique 4.4.
Une fois le bouchon retiré, si la bague d’inviolabilité est desserrée, retirez-la avant d’utiliser le médicament. Pour éviter la contamination de l’embout compte-gouttes et de la solution, il faut faire attention de ne pas toucher les paupières, les surfaces voisines ou d’autres surfaces avec l’embout compte-gouttes du flacon.
1. Ouvrez le sachet d’emballage juste avant d’utiliser le flacon pour la première fois, sortez-en le flacon. Inscrivez la date d’ouverture sur le carton ou sur l’étiquette du flacon dans l’espace prévu à cet effet.
2. Lavez-vous les mains.
3. Enlevez le bouchon.
4. Une fois le bouchon retiré, si la bague d’inviolabilité est desserrée, retirez-la avant d’utiliser le médicament.
5. Tenez le flacon tête en bas, entre le pouce et vos autres doigts.
6. Penchez votre tête ou celle de votre enfant doucement en arrière. Avec un doigt propre, tirez doucement la paupière vers le bas pour créer un sillon entre la paupière et l’œil. La goutte sera déposée à cet endroit.
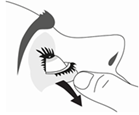

7. Rapprochez l’embout du flacon de l’œil. Utilisez un miroir pour vous aider.
8. Ne touchez pas l’œil, les paupières, les surfaces voisines ou d’autres surfaces avec le compte-gouttes. Cela peut infecter le collyre.
9. Appuyez légèrement sur le flacon pour libérer une goutte de TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution à la fois.
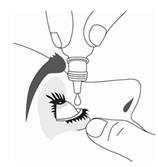

10. Après avoir utilisé TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution, gardez la paupière fermée, maintenez une légère pression en appuyant avec un doigt sur le coin de l’œil près du nez pendant au moins 1 minute. Ceci permet d’empêcher TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution d’aller dans le reste du corps.
11. Si vous devez traiter les deux yeux, recommencez ces étapes pour l’autre œil.
12. Refermez bien le flacon immédiatement après usage.
13. Utilisez un seul flacon à la fois.
Si une goutte tombe à côté de l’œil, recommencez.
Si vous ou votre enfant utilisez d’autres collyres ou pommades ophtalmiques en même temps, attendez au moins 5 minutes entre l’instillation de TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution et d’autres préparations ophtalmiques.
Voie d'administration
ophtalmique
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
Mise en garde et précautions d'emploi
Modification de la couleur des yeux
Le travoprost peut modifier progressivement la couleur des yeux en augmentant le nombre de mélanosomes (granules pigmentaires) dans les mélanocytes. Avant l’instauration du traitement, les patients doivent être informés du risque de changement permanent de la couleur de l’œil. Un traitement unilatéral peut avoir pour conséquence une hétérochromie définitive. Les effets à long terme sur les mélanocytes et leurs conséquences ne sont actuellement pas connus. La modification de couleur de l’iris évolue lentement et peut passer inaperçue pendant des mois, voire des années. Le changement de la couleur des yeux a surtout été observé chez des patients ayant l’iris bicolore, c’est-à-dire bleu-marron, gris-marron, jaune-marron et vert-marron ; cependant il a également été observé chez des patients ayant des yeux marron. Généralement, pour l’œil concerné, la pigmentation brune entourant la pupille s’étend de façon concentrique vers la périphérie, et l’iris peut devenir, en partie ou en totalité, brun plus foncé. Après l’arrêt du traitement, aucune augmentation ultérieure de la pigmentation brune de l’iris n’a été observée.
Modification de la peau périorbitaire et palpébrale
Au cours des essais cliniques contrôlés, un assombrissement de la peau périorbitaire et/ou palpébrale associé à l’utilisation du travoprost a été rapporté chez 0,4 % des patients. Des changements périorbitaires et ciliaires se traduisant par un approfondissement du sillon palpébral ont été observés avec les analogues de prostaglandines.
Le travoprost peut modifier progressivement les cils de l’œil ou des yeux traité(s). Au cours des essais cliniques ces changements, représentés par une augmentation de la longueur, de l’épaisseur, de la pigmentation et/ou du nombre de cils, ont été observés chez la moitié des patients environ. Le mécanisme de modifications des cils et ses conséquences à long terme sont actuellement inconnus.
Lors des études chez le singe, le travoprost a entraîné une légère augmentation de la fente palpébrale. Cependant, cet effet n’a pas été observé au cours des essais cliniques et est considéré comme étant spécifique à l’espèce.
Il n’y a pas de données concernant l’utilisation de du travoprost sur un œil inflammatoire, dans les glaucomes néovasculaire, congénital, à angle étroit ou à angle fermé. L’expérience est encore limitée en ce qui concerne les atteintes oculaires d’origine thyroïdienne, le glaucome à angle ouvert des patients pseudophaques et les glaucomes pigmentaire ou pseudoexfoliatif. Par conséquent le travoprost doit être utilisé avec précaution chez les patients présentant une inflammation intraoculaire active.
Patients aphaques
Des œdèmes maculaires ont été rapportés durant le traitement avec les analogues de la prostaglandine F2α. Il est recommandé d’utiliser le travoprost avec précaution chez des patients aphaques, pseudophaques présentant une rupture capsulaire du cristallin ou porteurs d’implant de chambre antérieure ou chez des patients présentant des facteurs de risques connus d’œdème maculaire cystoïde.
Iritis/uvéites
Chez les patients présentant des facteurs de risque connus aux iritis/uvéites, le travoprost devra être utilisé avec précaution.
Contact avec la peau
Le contact cutané avec le travoprost doit être évité étant donné que l’absorption transdermique a été démontrée chez le lapin.
Les prostaglandines et les analogues de prostaglandines sont des substances biologiquement actives pouvant être absorbées par la peau. Les femmes enceintes ou souhaitant le devenir devront prendre des précautions appropriées pour éviter une exposition directe au contenu du flacon. En cas de contact accidentel avec le contenu du flacon, laver immédiatement et soigneusement la zone concernée.
Lentilles de contact
Les patients doivent être informés d’enlever leurs lentilles de contact avant instillation de travoprost et d’attendre 15 minutes après l’instillation de travoprost avant de poser des lentilles de contact.
Population pédiatrique
L’efficacité et la tolérance dans le groupe d’âge 2 mois à < 3 ans (9 patients) sont limitées (voir rubrique 5.1). Aucune donnée n’est disponible pour les enfants de moins de 2 mois.
Pour les enfants de moins de 3 ans qui souffrent principalement de GCP (glaucome congénital primaire), la chirurgie, (en particulier la trabéculotomie/goniotomie) reste le traitement de première intention.
Aucune donnée de tolérance à long terme n’est disponible pour les sujets pédiatriques.
Excipients
TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution contient du chlorure de benzalkonium qui est connu pour provoquer une irritation des yeux, des symptômes du syndrome de l’œil sec et peut affecter le film lacrymal et la surface de la cornée. Doit être utilisé avec prudence chez les patients atteints d’œil sec et ceux présentant un risque d’endommagement de la cornée.
D’après les données limitées disponibles, le profil des effets indésirables chez l’enfant est semblable au profil chez l’adulte.
Toutefois, on observe généralement une réaction plus forte à un stimulus donné chez l’enfant que chez l’adulte. L’irritation peut avoir des effets sur l’observance du traitement chez les enfants.
Les patients doivent être surveillés en cas d’utilisation prolongée.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Les patients doivent retirer les lentilles de contact avant application de TRAVOPROST VIATRIS 40 microgrammes/ml, collyre en solution et attendre au moins 15 minutes après instillation avant de les remettre.
Condition de prescription
liste I
Groupe générique
TRAVOPROST 40 microgrammes/ml - TRAVATAN 40 microgrammes/ml, collyre en solution
Liste des médicaments de ce groupe de générique.Forme pharmaceutique
Non renseigné
Divers
Service Médical Rendu (SMR) : Non disponible
Présentation : 1 flacon(s) polypropylène de 2,5 ml avec embout(s) de dispensation polyéthylène basse densité (PEBD) suremballée(s)/surpochée(s)
Prix : 6.58
Taux de remboursement : 65%
Titulaire : VIATRIS SANTE