ABSTRAL 400 microgrammes, comprimé sublingual
Classe médicamenteuse
Analgésiques, opioïdes, dérivés de la phénylpipéridine | code ATC : N02AB03
Composition
Fentanyl (sous forme de citrate)........................................................................... 400 microgrammes
Pour un comprimé sublingual.
Indications thérapeutiques
Traitement des accès douloureux paroxystiques chez les patients adultes utilisant des morphiniques pour traiter les douleurs chroniques d’origine cancéreuse. L’accès douloureux paroxystique est une exacerbation passagère d’une douleur chronique par ailleurs contrôlée par un traitement de fond.
Posologie et mode d'administration
ABSTRAL est réservé aux patients considérés comme tolérants au traitement morphinique de fond de la douleur cancéreuse chronique. Peuvent être considérés comme tolérants aux morphiniques les patients recevant au moins 60 mg de morphine par jour par voie orale, au moins 25 µg de fentanyl par heure par voie transdermique, au moins 30 mg d’oxycodone par jour par voie orale, au moins 8 mg d’hydromorphone par jour par voie orale ou une dose équianalgésique d’un autre morphinique depuis une semaine minimum.
Mode d’administration
Les comprimés sublinguaux d’ABSTRAL doivent être placés directement sous la langue, le plus loin possible. Les comprimés sublinguaux d’ABSTRAL ne doivent pas être avalés, mais fondre complètement sous la langue, sans être mâchés ni sucés. Les patients doivent être informés qu’ils ne doivent pas manger ni boire avant dissolution complète du comprimé sublingual.
Les patients souffrant de sècheresse buccale peuvent utiliser de l’eau pour humidifier la muqueuse buccale avant la prise d’ABSTRAL.
Titration de la dose
L’objectif de la titration de la dose est d’identifier une dose d’entretien optimale pour le traitement des accès douloureux paroxystiques. Cette dose optimale doit permettre une analgésie adéquate avec un taux acceptable d’effets indésirables.
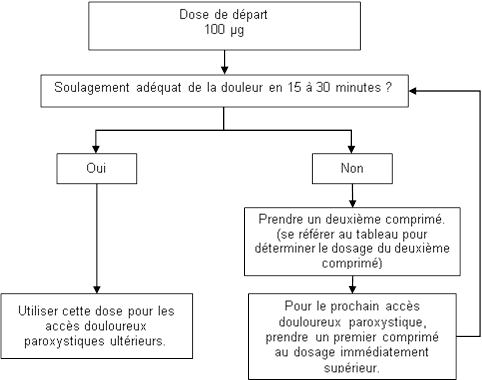
La dose optimale d’ABSTRAL doit être déterminée pour chaque patient par titration progressive. Plusieurs dosages sont disponibles et peuvent être utilisés pendant la phase de titration. La dose initiale d’ABSTRAL utilisée doit être de 100 µg, avec augmentation de la posologie si nécessaire, dans la gamme des dosages disponibles.
Les patients doivent être surveillés attentivement jusqu’à ce qu’une dose optimale ait été atteinte. La substitution d’ABSTRAL à d’autres produits contenant du fentanyl ne doit pas être effectuée dans un rapport de 1/1 dans la mesure où les différents produits ont des profils d’absorption différents. Tout remplacement d’un autre produit contenant du fentanyl par ABSTRAL doit donner lieu à une nouvelle titration.
Le schéma posologique suivant est recommandé pour la titration. Le médecin doit toutefois toujours prendre en compte les besoins cliniques du patient, son âge et ses maladies concomitantes.
Tous les patients doivent initier le traitement par un seul comprimé sublingual de 100 µg.
Si une analgésie adéquate n’est pas obtenue dans les 15 à 30 minutes suivant l’administration du comprimé sublingual :
- · un comprimé sublingual supplémentaire de 100 µg peut être administré ;
- · pour le traitement du prochain accès douloureux paroxystique il faudra envisager d’administrer le dosage supérieur (voir Figure ci-dessous).
L’augmentation posologique doit se poursuivre par étape jusqu’à obtention d’une analgésie adéquate avec des effets indésirables tolérables. Pour des doses initiales de 400 µg et plus, le dosage du comprimé sublingual supplémentaire doit être de 200 µg. Cela est illustré par le tableau ci-dessous.
Pendant la phase de titration, le patient ne peut pas recevoir plus de deux prises pour un seul accès douloureux paroxystique.
PROCEDE DE TITRATION D’ABSTRAL
|
Dosage (en µg) du premier comprimé sublingual par accès douloureux paroxystique |
Dosage (en µg) du second comprimé sublingual, à administrer au besoin 15 à 30 minutes après le premier comprimé |
|
100 |
100 |
|
200 |
100 |
|
300 |
100 |
|
400 |
200 |
|
600 |
200 |
|
800 |
- |
Si la plus forte dose permettant d’obtenir une analgésie efficace provoque des effets indésirables considérés comme inacceptables, une dose intermédiaire peut être administrée (en utilisant selon le cas le comprimé de 100 µg).
Pendant la phase de titration, les patients doivent être informés de la possibilité d’utiliser plusieurs comprimés de 100 µg et/ou de 200 µg comme dose unique. Le nombre de comprimés administrés pour le traitement d’un seul accès douloureux paroxystique ne doit pas être supérieur à quatre (4).
L’efficacité et la sécurité de doses supérieures à 800 µg n’ont pas été évaluées au cours des études cliniques menées chez des patients.
Afin de minimiser le risque d’effet indésirable lié aux morphiniques et de déterminer la dose appropriée, les patients doivent être placés sous surveillance médicale stricte pendant le processus de titration.
Pendant la phase de titration, les patients doivent attendre au moins 2 heures avant de traiter un autre accès de douleur paroxystique avec ABSTRAL.
Traitement d’entretien
Lorsque la dose appropriée, qui peut être supérieure à un comprimé, a été déterminée, elle doit continuer à être utilisée. La consommation doit être limitée à quatre doses d‘ABSTRAL par jour.
Pendant la période d’entretien, les patients doivent attendre au moins 2 heures avant de traiter un autre accès de douleur paroxystique avec ABSTRAL.
Réajustement de la dose
En cas d’observation d’une modification marquée de la réponse (analgésie ou effets indésirables), une nouvelle adaptation de la dose peut être nécessaire pour assurer le maintien d’une dose optimale.
Si le patient présente plus de quatre accès douloureux paroxystiques par jour pendant plus de quatre jours consécutifs, la dose du morphinique à longue durée d’action utilisée pour traiter la douleur chronique doit être réévaluée. En cas de modification de ce morphinique ou de sa posologie, la dose d‘ABSTRAL doit être réévaluée et éventuellement réadaptée pour garantir l’utilisation d’une dose optimale.
Toute nouvelle adaptation de la dose d’un analgésique, quel qu’il soit, doit être impérativement effectuée sous surveillance médicale.
En l’absence de contrôle adéquat de la douleur, la possibilité d’une hyperalgie, d’une tolérance au traitement ou de la progression d’une maladie sous-jacente doit être considérée (voir rubrique 4.4).
Durée et objectifs du traitement
Avant l’instauration du traitement par ABSTRAL, une stratégie thérapeutique comprenant la durée et les objectifs du traitement, doivent être convenus avec le patient, conformément aux lignes directrices relatives à la prise en charge de la douleur. Pendant le traitement, des contacts fréquents doivent avoir lieu entre le médecin et le patient afin d’évaluer la nécessité de poursuivre le traitement, d’envisager l’arrêt du traitement et d’ajuster les doses si nécessaire. En l’absence d’un contrôle adéquat de la douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4).
ABSTRAL ne doit pas être utilisé plus longtemps que nécessaire.
Arrêt du traitement
Le traitement par ABSTRAL doit être immédiatement arrêté dès que le patient ne présente plus d’accès douloureux paroxystiques. Le traitement de la douleur chronique de fond doit être maintenu comme prescrit.
Si l’arrêt de tous les traitements opioïdes est nécessaire, le patient doit être étroitement surveillé par le médecin afin d’éviter le risque d’apparition de symptômes liés à un sevrage brutal.
Utilisation chez l’enfant et l’adolescent
Compte-tenu de l’absence de données de sécurité et d’efficacité pour cette population, ABSTRAL ne doit pas être utilisé chez les patients de moins de 18 ans.
Utilisation chez le sujet âgé
La titration de la dose doit être particulièrement prudente et l’apparition éventuelle de signes de toxicité du fentanyl doit faire l’objet d’une surveillance stricte (voir rubrique 4.4).
Utilisation chez les patients insuffisants hépatiques ou rénaux
L’apparition éventuelle de signes de toxicité du fentanyl doit faire l’objet d’une surveillance stricte chez les patients atteints de troubles hépatiques ou rénaux (voir rubrique 4.4).
Voie d'administration
sublinguale
Contre-indications
- · Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
- · Patients non traités par un traitement de fond morphinique, en raison d’un risque accru de dépression respiratoire.
- · Dépression respiratoire sévère ou pathologies pulmonaires obstructives sévères.
- · Traitement de la douleur aiguë autre que les accès douloureux paroxystiques.
- · Patients traités par des médicaments contenant de l’oxybate de sodium.
Mise en garde et précautions d'emploi
En raison des risques, associés à l’exposition accidentelle, au mésusage et à l’abus, pouvant avoir une issue fatale, les patients et leurs aidants doivent être informés qu’ils doivent conserver ABSTRAL dans un endroit sûr et sécurisé, inaccessible à d’autres personnes.
Les patients et le personnel soignant doivent être informés qu‘ABSTRAL contient une substance active à une dose qui peut être mortelle pour un enfant. Par conséquent, tous les comprimés doivent être conservés hors de la vue et de la portée des enfants.
En raison des effets indésirables potentiellement graves des traitements morphiniques comme ABSTRAL, les patients et le personnel soignant doivent être informés de l’importance de la prise correcte d‘ABSTRAL et informés des mesures à prendre en présence de symptômes de surdosage.
Avant l’instauration d‘ABSTRAL, le traitement morphinique à longue durée d’action utilisé pour contrôler la douleur chronique doit avoir été stabilisé.
Tolérance et troubles liés à l’usage d’ opioïdes (abus et dépendance)
Une accoutumance et une dépendance physique et/ou psychologique sont susceptibles d’apparaître lors de l’administration répétée de morphiniques tels que le fentanyl.
L’utilisation répétée d’ABSTRAL peut mener à des troubles liés à l’utilisation d’opioïdes (TUO). Une dose plus élevée et une durée plus longue du traitement par opioïdes peuvent augmenter le risque de développer un TUO. L’abus ou le mésusage intentionnel d’ABSTRAL peut entraîner un surdosage et/ou le décès. Le risque de développement d’un TUO est majoré chez les patients ayant des antécédents personnels ou familiaux (parents ou fratrie) de troubles liés à l’utilisation de substances addictogènes (y compris de troubles liés à la consommation d’alcool), chez les fumeurs ou chez les patients ayant des antécédents personnels d’autres troubles mentaux (par exemple dépression majeure, anxiété et troubles de la personnalité).
Avant l’instauration du traitement par ABSTRAL et pendant le traitement, les objectifs du traitement et un plan d’arrêt doivent être convenus en accord avec le patient (voir rubrique 4.2). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d’apparition de ces signes, les patients doivent être invités à contacter leur médecin.
Les patients doivent être surveillés afin de détecter tout signe de comportement addictif (par exemple demandes trop précoces de renouvellement d’ordonnance). Cela inclut le passage en revue des médicaments psychotropes (tels que les benzodiazépines) et opioïdes concomitants. Chez les patients présentant des signes et symptômes de TUO, la consultation d’un addictologue doit être envisagée.
Dépression respiratoire
Comme tous les morphiniques, ABSTRAL est associé à un risque de dépression respiratoire cliniquement significative. La phase de titration doit être réalisée avec une prudence particulière chez les patients atteints de broncho-pneumopathie chronique obstructive ou d’une autre pathologie (par ex. : myasthénie grave) les prédisposant à une dépression respiratoire, en raison de la majoration du risque de dépression respiratoire pouvant entraîner un arrêt respiratoire.
Augmentation de la pression intracrânienne
ABSTRAL ne doit être administré qu’avec une extrême prudence aux patients susceptibles de présenter une sensibilité particulière aux effets cérébraux de l’hypercapnie, comme les patients présentant des signes d’hypertension intracrânienne, des troubles de la conscience, un coma ou des tumeurs cérébrales. Les morphiniques pouvant masquer l’évolution clinique chez les patients atteints de traumatismes crâniens, ils ne doivent être utilisés dans ce cadre qu’en cas d’absolue nécessité.
Hyperalgésie
Comme avec les autres opioïdes, en cas de contrôle insuffisant de la douleur en réponse à une augmentation de la dose de fentanyl, la possibilité d'une hyperalgésie induite par les opioïdes devrait être envisagée. Une diminution de la dose en fentanyl, une suspension du traitement ou sa réévaluation peut être indiquée.
Pathologie cardiaque
Le fentanyl peut provoquer une bradycardie. Il doit être utilisé avec prudence chez les patients présentant des antécédents de bradyarythmie ou une bradyarythmie préexistante.
Patients âgés, cachectiques ou affaiblis
Les données obtenues à la suite de l’administration intraveineuse de fentanyl suggèrent la possibilité d’une réduction de sa clairance et d’une augmentation de sa demi-vie chez les patients âgés, qui pourraient être plus sensibles à la substance active que les patients plus jeunes.
Les patients âgés, cachectiques ou affaiblis doivent faire l’objet d’une surveillance attentive en cas d’apparition de signes de toxicité du fentanyl, entraînant si nécessaire une réduction de la dose.
Insuffisance rénale ou hépatique
ABSTRAL doit être administré avec prudence chez les patients présentant des troubles hépatiques ou rénaux, en particulier pendant la phase de titration. L’utilisation d‘ABSTRAL chez des patients insuffisants hépatiques ou rénaux pourrait augmenter la biodisponibilité du fentanyl et réduire sa clairance systémique, ce qui pourrait entraîner une augmentation et une prolongation des effets morphiniques.
Hypovolémie et hypotension
Une prudence particulière doit être apportée au traitement des patients hypovolémiques ou hypotendus.
Utilisation chez les patients présentant des lésions buccales ou une mucite
ABSTRAL n’a pas été étudié chez les patients présentant des lésions buccales ou une mucite. Un risque d’augmentation de l’exposition systémique au médicament peut exister chez ces patients et une prudence particulière est donc recommandée pendant la titration.
Arrêt d’ABSTRAL
L’arrêt du traitement par ABSTRAL ne devrait pas entraîner d’effet notable, mais les symptômes possibles de sevrage incluent : anxiété, tremblements, sueurs, pâleur, nausées et vomissements.
Syndrome sérotoninergique
Il est conseillé de faire preuve de prudence lorsqu’ABSTRAL est administré en association avec des médicaments qui affectent les systèmes de neurotransmission sérotoninergique.
Un syndrome sérotoninergique, susceptible de mettre en jeu le pronostic vital, peut se développer lors de l'utilisation concomitante de médicaments sérotoninergiques tels que des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), ainsi qu’avec des médicaments qui altèrent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [IMAO]). Cela peut se produire aux doses recommandées.
Le syndrome sérotoninergique peut s’accompagner d’altérations de l'état mental (p. ex. agitation, hallucinations, coma), d’une instabilité du système nerveux autonome (p. ex. tachycardie, pression artérielle labile, hyperthermie), de troubles neuromusculaires (p. ex. hyperréflexie, incoordination, rigidité) et/ou de symptômes gastro-intestinaux (p. ex. nausées, vomissements, diarrhée).
En cas de suspicion de syndrome sérotoninergique, il convient d’arrêter le traitement par ABSTRAL.
Troubles respiratoires liés au sommeil
Risque lié à l'utilisation concomitante de médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés.
L'utilisation concomitante d'Abstral et de médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés peut entraîner une sédation, une dépression respiratoire, un coma et la mort. En raison de ces risques, la prescription concomitante avec ces médicaments sédatifs doit être réservée aux patients pour lesquels les autres options thérapeutiques ne sont pas possibles. Si la décision est prise de prescrire Abstral en concomitance avec des médicaments sédatifs, la dose efficace la plus faible doit être utilisée et la durée du traitement doit être la plus courte possible.
Les patients doivent être suivis de près pour détecter les signes et symptômes de dépression respiratoire et de sédation. A cet égard, il est fortement recommandé d'informer les patients et leurs soignants afin qu'ils soient conscients de ces symptômes (voir rubrique 4.5).
ABSTRAL 400 microgrammes, comprimé sublingual contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c’est à dire qu’il est essentiellement « sans sodium ».
Condition de prescription
prescription limitée à 4 semaines
Groupe générique
FENTANYL (CITRATE DE) équivalant à FENTANYL 400 microgrammes - ABSTRAL 400 microgrammes, comprimé sublingual
Liste des médicaments de ce groupe de générique.Forme pharmaceutique
Non renseigné
Divers
Service Médical Rendu (SMR) : Important
Présentation : plaquette(s) polyamide PVC aluminium avec fermeture de sécurité enfant de 10 comprimé(s)
Prix : 48.91
Taux de remboursement : 65%
Titulaire : LABORATOIRES GRUNENTHAL